【改称】
「薬事法」
=〉「医薬品、医療機器等の品質、有効性および安全性の確保等に関する法律」
【ポイント】
1 医薬品、医療機器等に係る安全対策の強化
・薬事法の目的に、保健衛生上の危害の発生・拡大防止のため必要な規制を行うことを明示する。
・医薬品等の品質、有効性及び安全性の確保等に係る責務を関係者に課す。
・医薬品等の製造販売業者は、最新の知見に基づき添付文書を作成し、厚生労働大臣に届け出るものとする。
2 医療機器の特性を踏まえた規制の構築
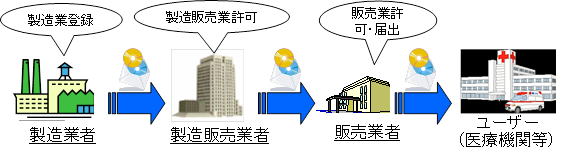
・医療機器の製造販売業・製造業について、医薬品等と章を区分して規定する。
・医療機器の民間の第三者機関による認証制度を、基準を定めて高度管理医療機器にも拡大する。
・診断等に用いる単体プログラムについて、医療機器として製造販売の承認・認証等の対象とする。
・医療機器の製造業について、許可制から登録制に簡素化する。
・医療機器の製造・品質管理方法の基準適合性調査について、合理化を図る。
3 再生医療等製品の特性を踏まえた規制の構築
・「再生医療等製品」を新たに定義するとともに、その特性を踏まえた安全対策等の規制を設ける。
・均質でない再生医療等製品について、有効性が推定され、安全性が認められれば、特別に早期に、条件及び期限を付して製造販売承認を与えることを可能とする。
【薬局対応】
最新の論文その他の知見に基づき添付文書の改訂が行われることから、最新の安全管理情報に基づく最適な措置を講ずる。
【参考】
・薬事法等の一部を改正する法律について(厚生労働省)
・医薬品医療機器等法における医療機器プログラムの取り扱い(医療機器センター)
『医薬品医療機器等法(薬機法)』 施行
 トピックス
トピックス